El Kevlar, capaz de quintuplicar la autonomía de los coches eléctricos
Un equipo de investigación de la Universidad de Michigan ha logrado incrementar notablemente la densidad energética de las baterías a través de la utilización de nanofibras de aramida provenientes de Kevlar reciclado.

En un sector como el de los coches eléctricos, en el que la autonomía es motivo de gran preocupación para los usuarios -principalmente por la ausencia de una red de recarga adecuada-, conseguir que las baterías evolucionen para proporcionar mayor capacidad se antoja clave en el futuro de la movilidad sostenible.
Pero avances como el conseguido por la Universidad de Michigan nos hacen ser optimistas, ya que este logro abre el camino a una mejora ostensible de la densidad energética de las baterías utilizadas para impulsar los coches eléctricos.
El Kevlar, clave en el proceso
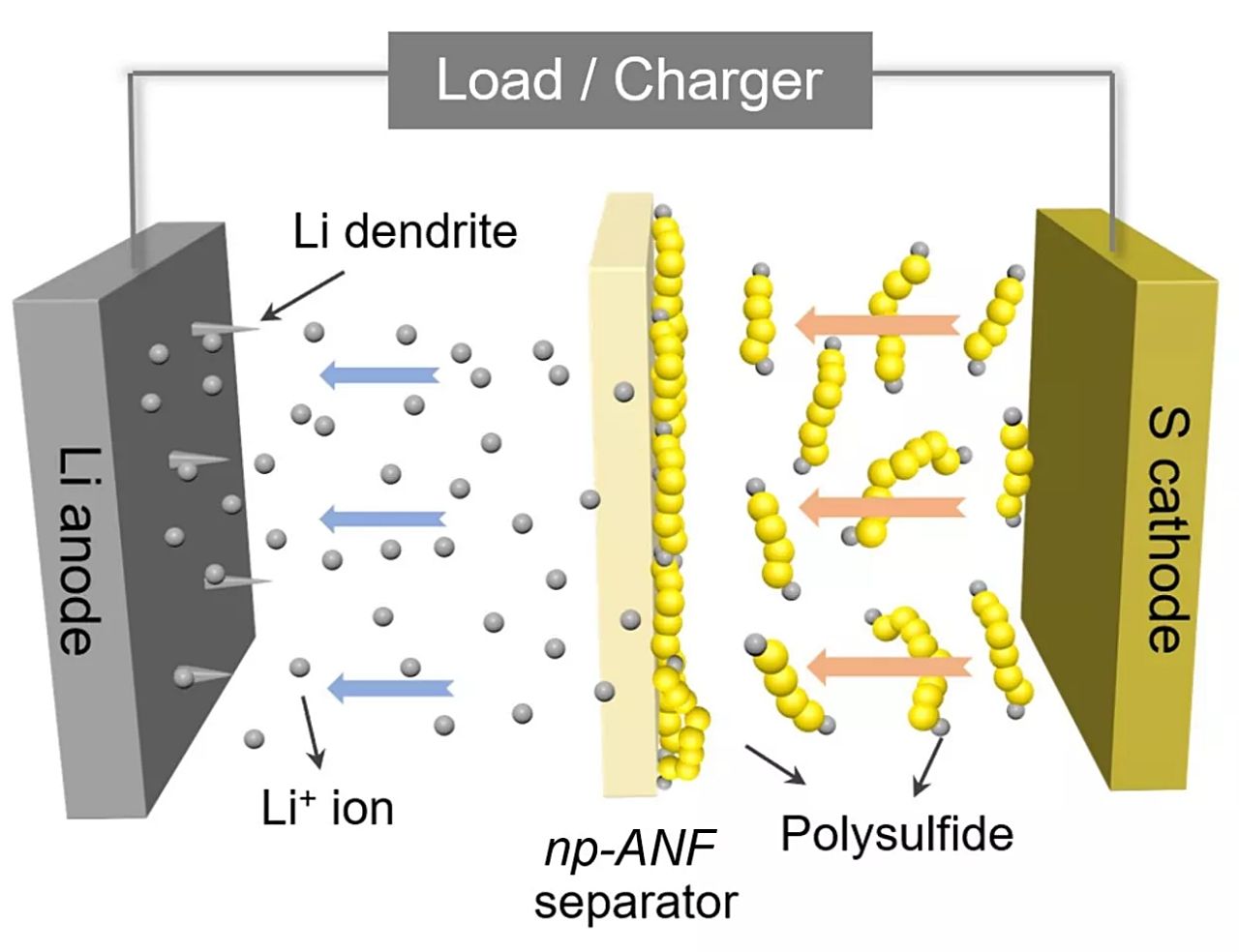
En concreto, el grupo de investigadores ha conseguido estabilizar la reacción química entre el ánodo de litio y el cátodo de azufre de una batería de litio de manera que es posible conseguir baterías con una capacidad muy superior a la normal.
Ello es posible gracias a que la densidad energética se quintuplica con ese nuevo proceso, que incluye el uso del Kevlar. O, más en concreto, de nanofibras de aramida recicladas de este material.
Esta red de aramida facilita el flujo de iones entre el litio y el azufre, contribuyendo además a evitar que se generen polisulfuros y otros restos que reducen la capacidad y la durabilidad de la batería.
Además, el informe científico asegura que las baterías basadas en este proceso aguantan más de 1000 ciclos de carga, lo que debería permitir una vida útil de al menos 10 años.
«Hay una serie de informes que afirman varios cientos de ciclos para las baterías de litio-azufre, pero se logra a expensas de otros parámetros: capacidad, tasa de carga, resiliencia y seguridad», apunta Nicholas Kotov, profesor distinguido de ciencias químicas e ingeniería de la Universidad Irving Langmuir, quien dirigió la investigación.
«Como batería, el diseño es casi perfecto, con su capacidad y eficiencia acercándose a los límites teóricos», señala Kotov. «También puede manejar las temperaturas extremas de la vida automotriz, desde el calor de la carga a pleno sol hasta el frío del invierno».
Qué es el Kevlar
El Kevlar es una fibra sintética para-aramida con resistencia térmica que tiene una estructura molecular de muchos enlaces entre cadenas que hacen que sea increíblemente fuerte. Reconocido por el uso en chalecos antibalas, el Kevlar también puede usarse en otras aplicaciones gracias a su proporción entre alta fuerza tensil y peso.
Fue creado por la pionera en investigación de polímeros, Stephanie Kwolek. La estructura química del Kevlar comprende varios enlaces entre cadenas recurrentes. Estas cadenas están entrelazadas con hidrógeno y proporcionan una fuerza tensil 10 veces mayor que el acero con un peso similar.
Además, las fibras de Kevlar están tan estrechamente hiladas que es prácticamente imposible separarlas. Cuando una bala u otro proyectil a alta velocidad las toca, estas lo atrapan mientras absorben y disipan su energía. También es conocida su resistencia a cortes y perforaciones o su resistencia térmica, ya que brinda protección contra temperaturas de hasta 426 ºC, siendo también resistentes al derretimiento, el goteo o la combustión.
La denominación Kevlar es una marca registrada de DuPont, pues en realidad el compuesto se denomina poliparafenileno tereftalamida.
Fuente: Michigan University

