
Europa presenta su primera batería de estado sólido y China responde con una acusación durísima
Desde China siguen renegando del gran avance presentado por parte de una fabricante europeo durante el CES de Las Vegas....
La electrólisis es el proceso en el que los elementos de un compuesto se separan mediante la aplicación de electricidad. Dicho de otro modo, la energía eléctrica se transforma en energía química.

¿Sabes qué es la electrólisis? En este vídeo te lo contamos.
El proceso químico denominado electrólisis ha adquirido mucho protagonismo en los últimos años, ya que es clave en el proceso de producción de hidrógeno verde. Sin embargo, no es una novedad, ya que lleva utilizándose durante décadas en otras muchas aplicaciones.
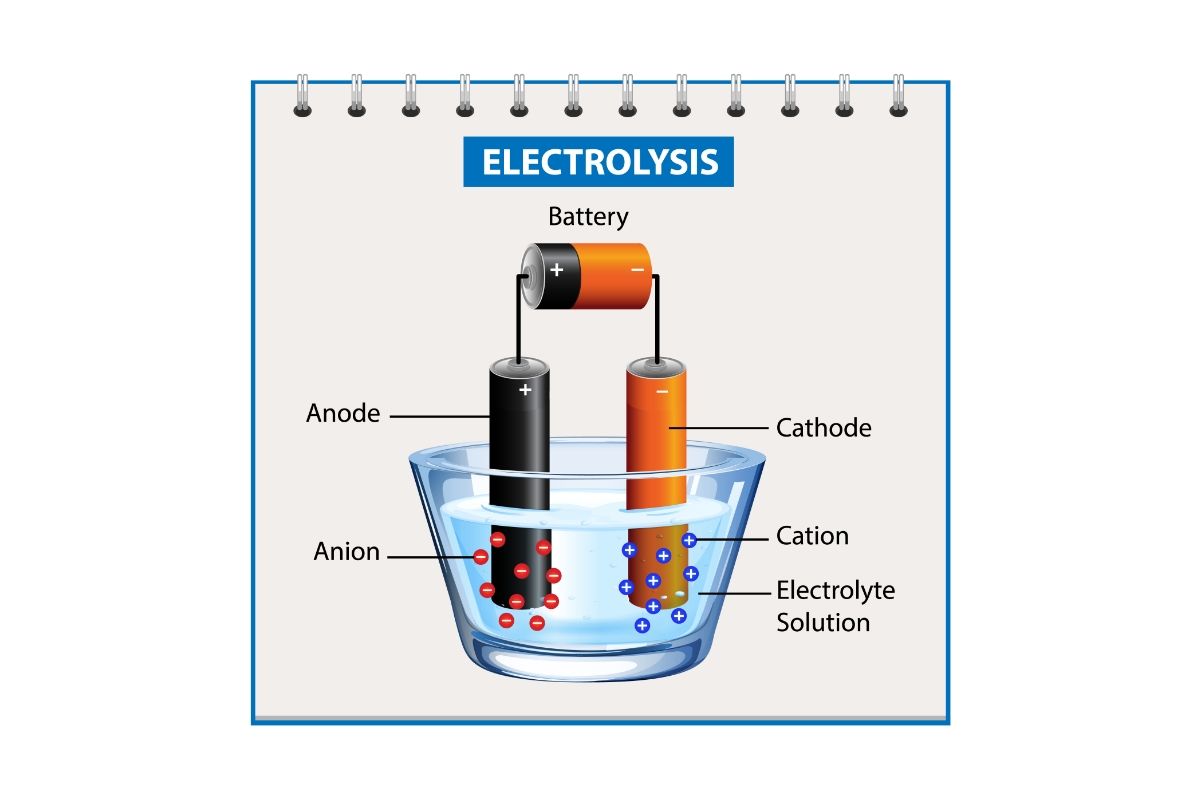
Para que se produzca el proceso electroquímico denominado electrólisis, son necesarios dos elementos, además de la corriente eléctrica que hará posible la reacción química no espontánea: los electrodos y el electrolito.
La unidad de electrólisis está formada por dos electrodos y un electrolito. Los electrodos son los conductores eléctricos utilizados para hacer contacto con la parte no metálica de un circuito. Estos dos elementos, el ánodo y el cátodo, transfieren iones entre sí, haciendo posible la reacción química.
El ánodo (+) es un electrodo que pierde electrones, propiciando una reacción de oxidación. Estos electrones desprendidos del ánodo van a parar al cátodo. Los materiales habitualmente utilizados en la fabricación de ánodos son compuestos de grafito natural en escamas, microesferas de carbono mesofase y grafito artificial de coque de petróleo.
El cátodo (-) es un electrodo que recibe los electrones provenientes del ánodo, produciéndose una reacción de reducción. El cátodo siempre se fabrica con metales, aunque estos pueden ser muy diversos. Los más habituales son el litio, el hierro, el aluminio, el cobalto y el manganeso.
Desde el punto de vista químico, un electrolito es cualquier sustancia que contenga iones libres. Estos iones libres son los que convierten a dicha sustancia en un conductor eléctrico.
De un modo más práctico, el electrolito es una solución acuosa o salina en la que se sumergen los electrodos (ánodo y cátodo). El conjunto de todos estos elementos se denomina célula de electrólisis. El electrolito permite la transferencia de iones entre el ánodo y el cátodo al aplicarse una corriente eléctrica.
Algunos aspectos importantes a tener en cuenta a la hora de realizar el proceso de electrólisis es que los electrodos nunca deben entrar en contacto directo, pues en ese caso del proceso no se completa y la batería se sobrecalentará y quemará.
Además, la corriente eléctrica aplicada debe ser siempre continua. Es decir, nunca a través de un enchufe, sino de una batería o adaptador de corriente. Finalmente, es importante que los gases desprendidos (oxígeno e hidrógeno) no contacten entre sí, pues de lo contrario volverían a producir agua.
El proceso de electrólisis está de moda porque se utiliza para producir hidrógeno verde y también en las baterías, incluidas las de los coches eléctricos. Pero su utilidad es bien conocida desde hace décadas para muchas otras aplicaciones:
En nuestra sección Diccionario, puedes aprender más sobre otros procesos, materiales y piezas relacionadas con los vehículos.

Desde China siguen renegando del gran avance presentado por parte de una fabricante europeo durante el CES de Las Vegas....

La carrera por los coches eléctricos no cesa, y tampoco las de las tecnologías para los híbridos enchufables. Como los...

Ford sigue buscando nuevas alianzas de cooperación. Un interesante informe americano ha desvelado que la marca del ovalo azul estaría...

CATL es uno de lo grandes gigantes mundiales que lideran el desarrollo de baterías, y la protagonista de un importante...

Hyundai ha decidido lanzar el nuevo NEXO en Europa. La marca coreana ha anunciado el precio para este SUV eléctrico...